화학 시뮬레이션
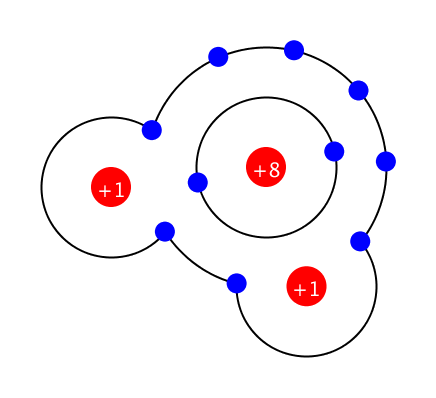
알칸(알케인) 탄화수소 화합물
‘C’ 버튼을 누르면 탄소가 추가되고, ‘H’ 버튼을 누르면 수소원자, ‘O’ 버튼을 누르면 산소원자가 추가됩니다. 추가되는 원자들은 랜덤하게 배치되기 때문에 정확한 모양이 나오지 않을 수 있습니다. 탄소 30개 이하의 분자를 만들 수 있습니다. 원자의 위치를 옮길 수 있습니다. 이 시뮬레이션에서는 단일 … more
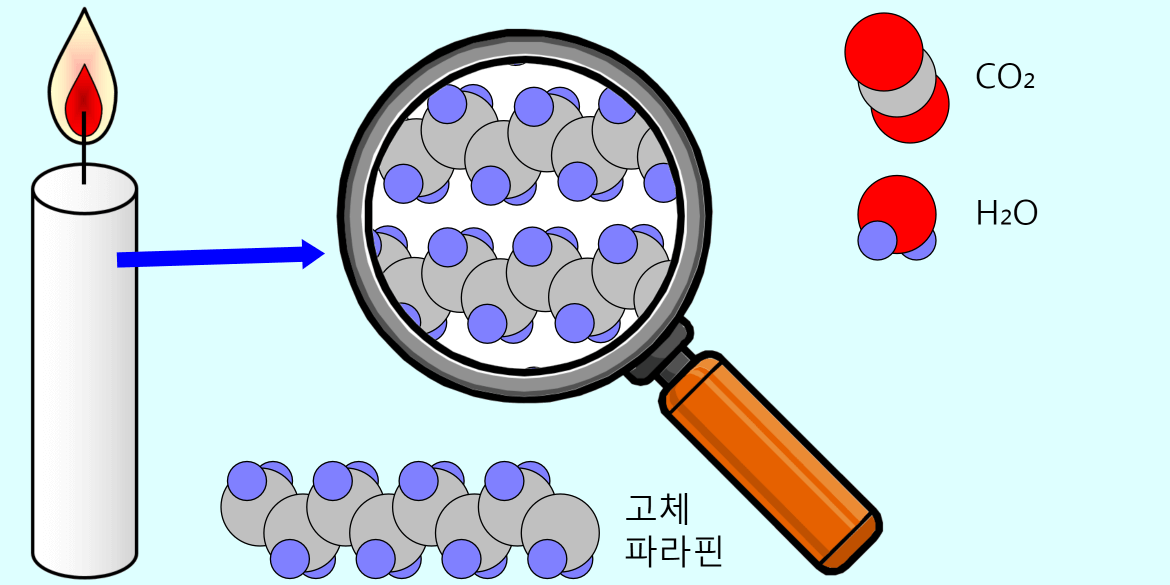
양초에서 일어나는 화학 변화
양초의 주재료인 파라핀 양초의 주재료에 해당되는 파라핀은 20~40개의 탄소원자들이 사슬형태로 연결된 알케인(알칸) 탄화수소를 말합니다. 극성 용매인 물에는 녹지 않으나 에테르, 벤젠 등의 무극성 용매에는 잘 녹습니다. 석유화학 공정에서 만들어 집니다. 양초의 연소 어떤 물체가 연소된다는 것은 산소와 결합하여 빛과 열을 … more
기체 반응의 법칙 – 암모니아 합성
암모니아 합성과정 암모니아는 비료, 플라스틱 재료, 의약품, 생활용품 등 광범위하게 사용되는 재료 물질입니다. 현재 암모니아는 공장에서 대량 생산되고 있습니다. 하지만 암모니아의 합성 과정을 몰랐던 과거에는 암모니아가 오직 생물체만 생성할 수 있는 물질이라 생각했습니다. 암모니아의 합성 과정은 다음과 같습니다. N2 + … more
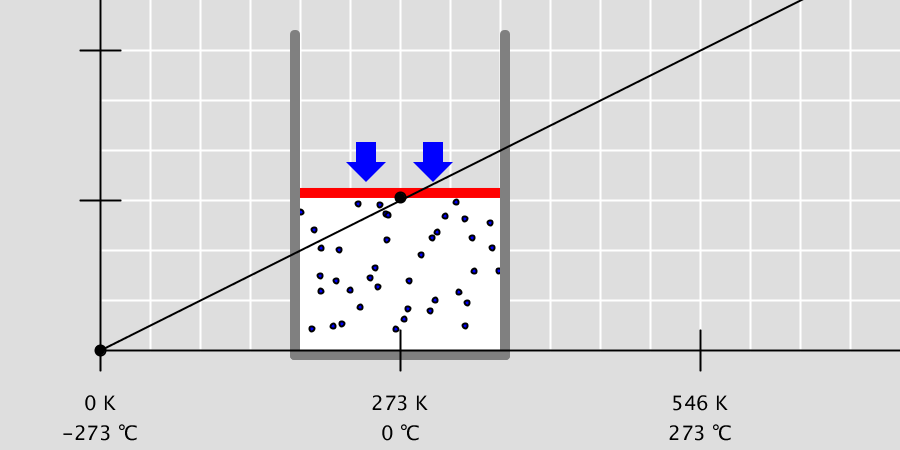
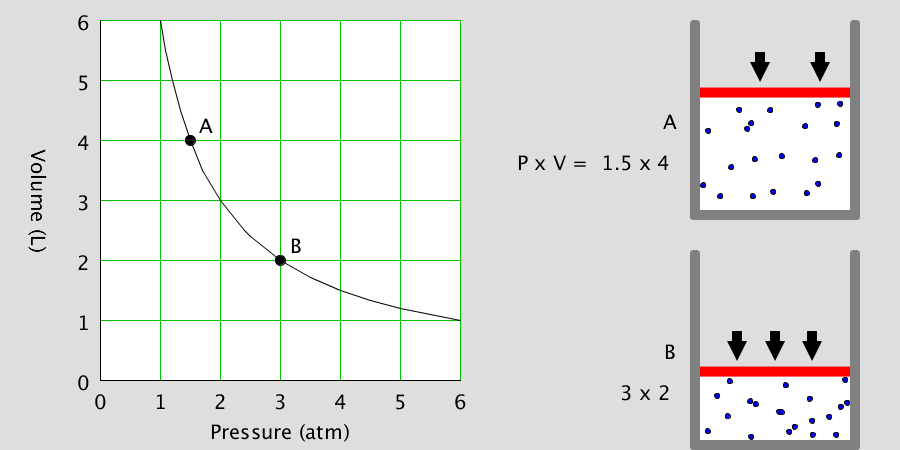
기체 반응의 법칙 – 수증기 합성
기체 반응의 법칙 수소 기체와 산소 기체가 반응하면 수증기를 생성합니다. 이 때, 수소 기체와 산소 기체는 2:1의 부피비로 반응하여 2부피의 수증기를 생성합니다. 이와 같이 일정한 온도와 압력에서 기체들이 반응하여 새로운 기체가 생성될 때 각 기체의 부피 사이에는 항상 간단한 정수비가 … more
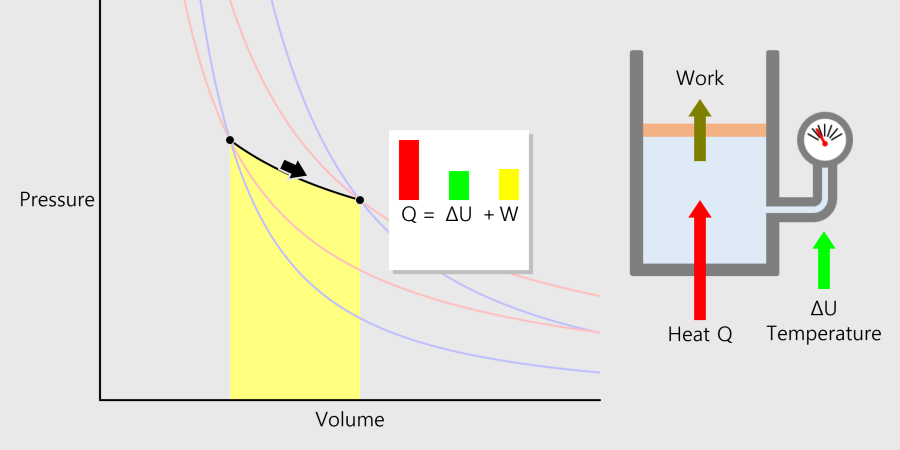
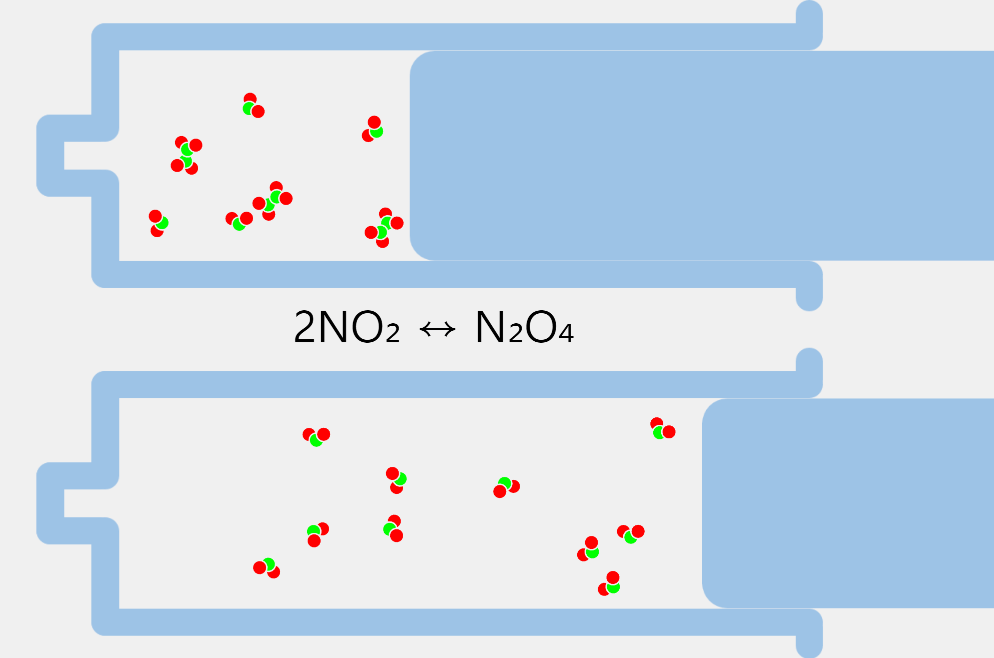
르 샤틀리에의 원리
르 샤틀리에의 원리(압력과 화학 평형 이동) 예를 들어 어떤 가역 반응이 평형 상태에 있을 때, 평형계의 압력을 증가시키면 증가된 압력을 감소시키려는 방향으로 반응이 진행되어 압력이 높아지는 변화를 줄이려고 합니다. 평형 상태의 반응에서 압력을 높이면 기체의 몰수가 감소하는 방향으로 평형이 이동하고, … more